PROTEINES QCM1
BCD/ A : il y a 300 protéines naturels mais seulement 20 qui rentrent dans la composition des protéines ; E : il possède une fonction amiNe
QCM2
BE/ /! La tyrosine est un aromatiques mais elle est rangée avec les alcools
QCM3
AC/ B : les acides aminés
apolaires permettent le repliement. Les
polaires permettent la solubilité, de former des liaisons, et la réactivité ; D : la cystéine possède un pKa
3= 8 ; E : la méthionine possède une fonction soufrée NON réactive
QCM4
ADE/ B : tous les acides aminés sont
S sauf la proline et la glycine ; C : la masse relative dépend du radical R (par la chaîne latérale)
QCM5
BDE/ A : le pKa
2 correspond à la fonction amine ; C : la forme isoélectrique signifie que les charges sont présentes mais se compensent
QCM6
CD/ A : la
transamination est un transfert d’un acide aminé. La
désamination est une perte d’un groupement amine ; B : la décarboxylation permet la synthèse d’une amine en enlevant l’acide carboxylique ; E : la transformation de l’histidine en histamine est une décarboxylation
QCM7
ABDE/ C : la noradrénaline est un neurotransmetteur. C’est la L-dopa dans le mélanocyte qui synthétise la mélanine (pigment retrouvé au niveau de la peau, cheveux etc)
QCM8
AB/ C : on compte 20 000 à 25 000 gènes mais près de 5 millions de protéines différentes ; D : le protéome correspond à l’ensemble des protéines exprimées. La protéomique correspond à la science qui étudie les protéines ; E : la N-glycosylation se fait sur une asparagine ou glutamine
QCM9
BCE/ A : la glycation est la fixation d’un glucose sur un résidu LYSINE ; D : la PERTE d’un peptide signal
QCM10
D/ A : une protéine est un polymère ordonné d’acides aminés de série L ; B : c’est une liaison AMIDE ; C : lors de la liaison peptidique, la conformation sera toujours TRANS sauf pour la glycine et la proline ; E : lorsque le pH est égal au pHi, le résidu ne migre pas
QCM11
ABE/ C : les aminopeptidases coupent APRES tous les acides aminés en N-term (sauf la proline) ; D :la trypsine coupe après la lysine et l’arginine
QCM12
BC/ A : la structure secondaire est maintenue par liaisons faibles ; D : la structure QUATERNAIRE donne l’activité de la protéine dans l’organisme ; E : l’association se fait SANS liaisons covalentes
QCM13
AD/ B : la chromatographie par affinité dépend de la spécificité aux anticorps ; C : Lors de l’électrophorèse SDS PAGE, plus la molécule est légère, plus elle migre vers l’ANODE ; E : la méthode de Lowry possède une sensibilité de 10 mg/
QCM14
CD/ A : K
1 est la constante de vitesse d’association ; B : plus K
D est PETIT, plus l’affinité est grande
D et E méthodes : pente= -K
A= -1/K
D et
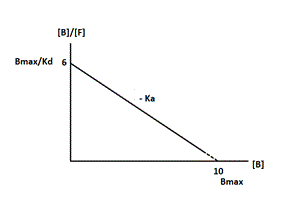
Donc 6=10/K
D soit K
D= 10/6= 1,7. Donc pente= -1/1,7= -0,59
QCM15
ACD/ B : la forme R correspond à la forme active ; E : dans le modèle concerté les changements ont lieu en même temps
QCM16
CE/ A : monomérique ; B : l’hème est la partie non protéique ; D : rôle de l’hémoglobine
QCM17
B/ Méthodes : BrCN coupe après la méthionine, La carboxypeptidase coupe AVANT les acides aminés en C-term, L’aminopeptidase coupe APRES les acides aminés en N-term
sauf pour la proline et il y a deux aromatiques.
QCM18
AE/ B : L’acide aminé concerné est
l’histidine. Seules les aromatiques absorbent dans les UV ; C : le tryptophane possède un noyau indole ; D : l’acide aspartique provient de l’asperge
QCM19
CDMéthode:
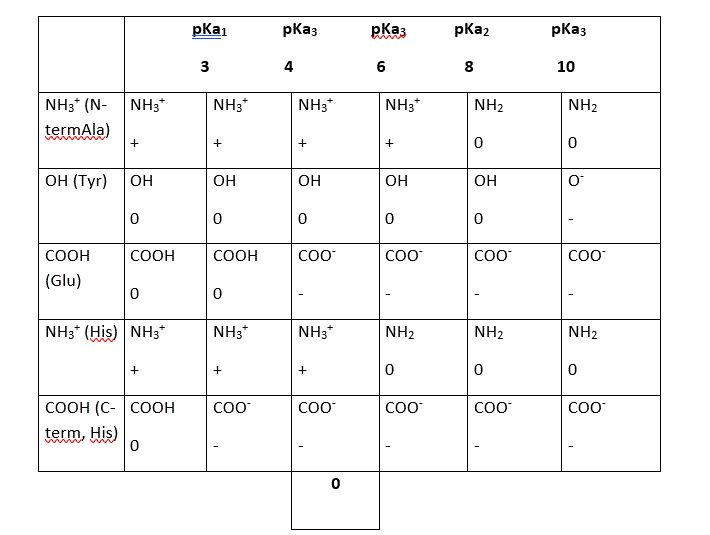
Il faut regarder où les charges se compensent. Ensuite : pHi= (4+6) /= 5
A pH= 4, pHi > 4 donc on a une migration vers la cathode (-)
BIOENERGETIQUE QCM1
ABD/ C : un système ouvert échange de l’énergie et de la matière ; E : à l’état d’équilibre, il perd son organisation et ne fournit plus de travail. C’est l’état stationnaire qui nécessite une haute organisation
QCM2
ACE/ B : la cellule est un système ouvert ; D : c’est l’enthalpie qui reflète la quantité de liaisons dans les réactifs et les produits
QCM3
BE/ ACD : caractéristiques des réactions cataboliques
QCM4
BCDE/ A : lorsque l’on a une libération d’énergie libre on parle de réaction exergonique et spontanée
QCM5
AC/ B : ΔG= ΔH-TΔS ; D : 1atm= 101,3
kPa ; E : 0°= 273 K soit 25°=298 K
QCM6
ADE/ B : il n’y a aucun stock d’ATP +++++ ; C : l’hydrolyse est associée à des ions Mg2+
QCM7
E QCM8
ABC/ D : c’est l’inverse, Les électrons vont tendre à se déplacer spontanément à travers le circuit externe de la demi-pile ayant le E’0 le plus
faible vers le E’0 le plus
fort ; E : le potentiel de réduction standard NE dépend PAS uniquement des espèces chimiques mais aussi de leurs activités ou concentrations
QCM9
D/ A : NADP+ dérive de la niacine ; B : FMN, NADP+, NAD+ et FAD sont des cofacteurs SOLUBLES dans l’eau ; C : C’est NADP+ qui possède un groupement phosphate fixé sur le ribose ; E : FADH2 est la forme réduite
QCM10
ABCDE QCM11
C/ Méthode : K’eq= [produits]/[réactifs]= 2,4/0,5= 4,8
QCM12
A/ Méthode : ΔG’= ΔG’0+ RTln(K’eq) = -30,5.103 + 8,3 x (25+273) x ln([0,00035 x 1.10-3]/ [3.5.10-3]
QCM13
D/ Méthodes : On sait que ΔG'= -n.f.ΔE' ( soit ΔE'= ΔG'/ -nf) et ΔG'= ΔG'0 + RTln([produits]/[réactifs]). Donc on calcule d’abord ΔG' ( qui vaut -11 kJ/mol)et ensuite on calcule ΔE'. Sans oublier que n=2 et f= 96 000
QCM14
BE/ ACD : il suffit de regarder la valeur de ΔG'.
QCM15
BE/ A et C : on a une réduction de l’acétaldéhyde et une oxydation du NADH ; D : ΔG'0= -n.f.ΔE'0. Sachant que ΔE'0= E’0 du couple le moins oxydant - E’0 du couple le plus réducteur ( donc il vaut 0,133)?
CHIMIE ORGANIQUE I QCM1
ABDE/ C : c’est l’effet inducteur I-
QCM2
AD/ B : un carbanion est un atome de carbone ayant gagné un électron ; C : nous obtenons un carbocation ; E : l’effet mésomère prime toujours sur l’effet inducteur !
QCM3
BCE/ A : les molécules sont d’autant plus réactives qu’il existe de mésomères ; D : elle est appelée énergie de résonnance
QCM4
AB/ C : ils possèdent des fonctions chimiques
différentes ; D : isomères de chaîne = isomères de position ; E : ce sont les isomères de constitution qui possèdent des propriétés physico-chimiques différentes
QCM5
AC/ B : la tautomérie c’est la transformation d’une fonction en une autre fonction par déplacement facile et rapide d’un atome d’hydrogène entre deux atomes ; D : dans Fischer, les liaisons verticales sont au-DESSOUS du plan ; E : elle représente la configuration INVERSE de celle trouvée en Cram (Ce QCM sert à bien vous mettre à l’esprit les bases de la chimie organique et comment sont représenter les molécules)
QCM6
ADE/ B : c’est une molécule achirale est superposable à son image dans un miroir plan ! De plus j’ai fait exprès de pas mettre « dans un miroir », faites attention la chiralité c’est la SUPERPOSITION et DANS UN MIROIR ; C : Attention PAS TOUJOURS
QCM7
CE/ A : deux énantiomères sont images l’une de l’autre mais ne sont PAS superposables ; B : deux molécules énantiomères diffèrent par leur CONFIGURATION (retenez bien la différence entre conformation et configuration +++) ; D : une lumière déviée vers la droite à
dextrogyre, une lumière déviée vers la gauche à
lévogyre QCM8
ADE/ B : une molécule à n C* possède 2n isomères optiques ; C : les énantiomères diffèrent par la configuration de DEUX carbones asymétriques (et les diastéréoisomères d’un seul +++)
QCM9
CDE/ A : c’est la substitution ; B : pas forcément, il peut y avoir rupture de liaisons notamment les liaisons doubles
QCM10
AD/ B : ce sont les solvant possédant un rôle chimique ; C : les hydrocarbures sont des solvants aprotiques APOLAIRES ; E : une augmentation de la pression accélère la réaction pour les réactifs gazeux
QCM11
ABE/ C : le carbanion le plus stable est celui le MOINS substitué ; D : les électrophiles réagissent avec les zones de forte densité électroniques
QCM12
BC/ A : c’est une réaction mono-moléculaire ; D : ce sont des dérivés halogénés tertiaire ; E : ça sera le plus électronégatif qui sera substitué
QCM13
CD/ A : il n’y a qu’une seule étape passant par un état de transition ; B : ça sera de forme Z OU de forme E mais pas les deux +++ ; E : le processus implique des halogènes primaires
QCM14
ABDE/ C : on utilise -hydroxy lorsque l’alcool n’est PAS la fonction de la molécule principale (tableau cours chimie orga 2 +++)
QCM15
A/ B : elle permet d’obtenir un éther symétrique ; C : ils possèdent un caractère faiblement basique ; D : les thiols sont des homologues SOUFRES des alcools ; E : les thiols sont PLUS acides que les alcools