ENZYMOLOGIE QCM1 Généralités sur les enzymes
- Dans la majorité des cas, une enzyme est un ribozyme
- Le rôle d’une enzyme est de catalyser une réaction chimique
- Les enzymes se lient au substrat par des liaisons faibles
- Les enzymes possèdent une masse moléculaire faible
- Les enzymes possèdent un site catalytique et un site de reconnaissance
QCM2 Les enzymes
- Sont des micromolécules
- Sont thermostables
- Agissent à très faible concentration
- Sont spécifiques d’une réaction donnée
- Ne sont pas regénérées à la fin
QCM3 Concernant les coenzymes
- Ce sont des métabolites non protéiques
- Ils sont dérivés de vitamines hydrosolubles
- Ils possèdent une faible masse moléculaire
- Ils agissent à forte concentration
- Les coenzymes liés s’associent au moment de la catalyse à la partie protéique appelée l’apoenzyme pour former un complexe fonctionnel nommé l’holoenzyme
QCM4 Les isoenzymes
- Proviennent de gènes apparentés mais codés différemment
- Possèdent des propriétés similaires
- Possèdent des formes physiquement similaires
- Se différencient par la distribution cellulaire
- Possèdent une même activité catalytique
QCM5 La nomenclature internationale des enzymes est (EC X. Y. Z. W). Que représente les lettres de la nomenclature ?
- X représente la sous classe de l’enzyme
- W représente le numéro de l’ordre dans la sous sous-classe
- Z représente la classe de l’enzyme
- Y représente la sous-classe de l’enzyme
- Z représente le numéro de l’ordre dans la sous sous-classe
QCM6 Parmi les différentes classes enzymatiques
- L’oxydoréductase catalyse les réactions d’oxydoréduction
- L’hexokinase est une hydrolase
- Les lyases catalysent le clivage de diverses liaisons par élimination
- Les isomérases catalysent le réarrangement structural de la molécule
- Les synthases ont besoin d’ATP et d’eau
QCM7 Applications médicales
- L’absence d’enzymes dans le plasma peut témoigner d’un infarctus
- Lors d’inflammation sans gravité, les enzymes sont de natures mitochondriales
- La myoglobine est un marqueur utile pour le diagnostic
- Le profil de proenzymes identifie le tissu malade
- Le dosage du glucose sanguin est utilisé dans le cas de maladies hépatiques ou osseuses
QCM8 Les enzymes thérapeutiques
- Sont stables
- Agissent de manière ciblée
- Sont obtenues depuis les années 80 à partir de sources non humaines
- Sont présents seulement dans le plasma
- Sont peu immunogènes
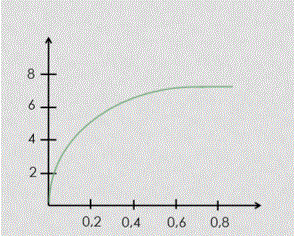
QCM9 Thermodynamique de l’enzymologie. Soit la réaction A + B --> X --> P + Q
- Lorsque la température diminue, la réaction accélère
- L’ajout d’un catalyseur va modifier l’énergie de Gibbs
- En augmentant le nombre d’étapes élémentaires, on augmente le nombre d’intermédiaires et on fractionne l’énergie d’activation
- Le modèle de Koshland correspond au concept de la clé/serrure
- Lorsque la température est comprise entre 40° et 50° C, on note une augmentation de la vitesse enzymatique