QCM12 Concernant les différentes structures de la protéine
- La structure secondaire est stabilisée par des liaisons fortes
- La structure feuillet plissé bêta correspond à un accolement de chaînes de façon non-périodique
- La structure tertiaire est composée d’une succession de régions ordonnées réunis par des zones non ordonnées
- La structure tertiaire permet l’activité de la protéine dans l’organisme
- Dans la structure quaternaire, l’association se fait par liaisons covalentes
QCM13 Méthodes d’études de la structure d’une protéine
- Lors de la chromatographie par échange d’ions, les protéines sont mises dans un récipient en présence de solides chargés
- La chromatographie par affinité dépend du poids moléculaire de la protéine
- Lors de l’électrophorèse SDS PAGE, plus la molécule est légère, plus elle migre vers la cathode
- Lors de l’électrophorèse de zone, on fait passer un courant entre l’anode et la cathode
- La méthode de Lowry possède une sensibilité de 1 g/L
QCM14 Interaction protéines-ligand
- K1 représente la constante de vitesse de dissociation
- Plus KD est grand, plus l’affinité augmente
- [L] représente la concentration en ligand libre à l’équilibre
Soit la représentation de Scatchard.Quelle est la valeur de la pente de la droite ?

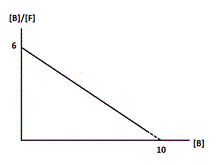
D. -0,59
E. -1,6
QCM15 Concernant l’allostérie
- L’allostérie est un mode de régulation de l’activité d’une enzyme par lequel la fixation d’une molécule effectrice en un site modifie les conditions de fixation d’une autre molécule, en un autre site distant de la protéine
- La forme R de la protéine allostérique correspond à la forme passive
- Les protéines allostériques sont caractérisées par la sensibilité de la régulation
- L’ensemble des effecteurs homotropes et hétérotropes constitue les effecteurs allostériques
- Dans le modèle concerté, on a un changement conformationnel de proche en proche
QCM16 La myoglobine
- Est tétramérique
- Contient une partie strictement protéique : l’hème
- Stocke le dioxygène
- Transporte le dioxygène
- L’hème est formé d’un noyau tétrapyridique
QCM17 Soit le peptide M composé de six acides aminés : Met, Tyr, Glu, Gly et Pro.
Traité par BrCN, on obtient 2 tripeptides A et B. La carboxypeptidase A libère Met à partir de A et Glu à partir de B. L’aminopeptidase n’a pas d’action sur B ; elle libère Gly à partir de A. Les poly peptidases A et B absorbent dans l’UV. On en déduit que M est
- N-term-Gly-Pro-Met-Gly-Pro-Met-C-term
- N-term-Gly-Tyr-Met-Pro-Tyr-Glu-C-term
- N-term-Gly- Met-Pro-Gly-Pro-Met-C-term
- N-term-Met-Tyr-Gly-Glu-Tyr-Pro-C-term
- Les propositions A, B, C et D sont fausses
QCM18 A propos de l’acide aminé protéinogène X de formule C
6H
9N
3O
2 à pH= 1
- C’est un acide aminé polaire chargé, à fonction basique
- Il absorbe dans les UV
- Il possède un noyau indole
- Il provient de l’asperge
- Il possède un carbone asymétrique
QCM19 Soit le peptide N-term-Ala-Tyr-Glu-Leu-Pro-His-C-term. Données : pKa
3(Tyr)= 10 et pKa
3(His)= 6. Combien vaut le pHi ?
- 9
- 7
- 5
Le peptide va migrer vers
- Vers la cathode à pH= 4
- A pH= 7, il ne migre pas



